Wir haben einen Apfel geviertelt und in 2 Viertel je 2 Münzen gesteckt. Eine davon bestand aus Zink und die andere aus Kupfer. Nun wurden die Apfelstückchen an den Münzen mit einem Messgerät verbunden.

- Messwert: -0.972 Volt
- Dann vertauschten wir die Anschlüsse. Damit war klar, wo der Pluspol ist.
- Messwert: 0,972 Volt Die Leuchtdiode leuchtet allerdings noch nicht.
- Nun machten wir eine Serienschaltung indem wir zwei präparierte Apfel-Viertel an das Messgerät anschlossen. Die beiden Elemente wurden in Serien, d.h. hintereinander geschaltet. Es wurde der Minuspol des ersten Elements mit dem Pluspol des zweiten verbunden. Die Spannung wurde dann an den beiden „losen“ Polen (+ und – ) gemessen.
- Neuer Messwert: 1,943 V. Nun hatten wir ausreichend Spannung und die Leuchtdiode leuchtete.
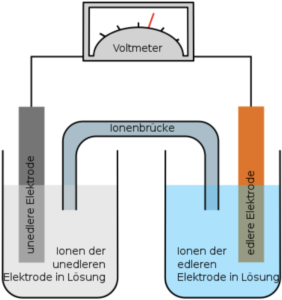
- Erkenntnis: Das unedlere Metall (Zink) zersetzt sich. Genauer: es sondert Elektronen ab und wird dadurch abgebaut. Die Elektronen lagern sich auf dem edleren Metall (Kupfer) ab bzw. reagieren mit den Kupferionen in der Kupfersulfatlösung, sodaß neues Kupfer gebildet und auf der Elektrode angelagert wird. Die Ionenbrücke sorgt für den Ionen-Autausch, ohne den der Ausgleich der Ladungen zu schnell stattfinden und dann kein Strom mehr fließen würde.
Hier der Aufbau einer Galvanischen Zelle:
 Kupfersulfat
Kupfersulfat
Zinksulfat
